 W
WPrzemiana fazowa – proces termodynamiczny, polegający na przejściu jednej fazy termodynamicznej w drugą, zachodzący w kierunku zapewniającym minimalizację energii swobodnej układu.
 W
WAnaliza termiczna, analiza cieplna – analiza polegająca na określaniu zakresu temperatur, w których w ogrzewanych lub ochładzanych materiałach zachodzą przemiany chemiczne lub fizyczne, np. przemiany fazowe w stopach lub zmiany usieciowania polimerów. Obserwowane lub rejestrowane są zmiany właściwości materiału, ogrzewanego lub studzonego w kontrolowanym tempie. W przypadku stosowania rejestracji wyników pomiarów analizę termiczną nazywa się „analizą termograficzną” lub „termografią”
 W
WCiśnienie krytyczne – graniczne ciśnienie, poniżej którego nie jest możliwe przeprowadzenie gazu w stan ciekły w temperaturze krytycznej. Jest jednym z parametrów punktu krytycznego. Po przekroczeniu ciśnienia, jak i temperatury krytycznej, substancja przechodzi w stan nadkrytyczny.
 W
WCiśnienie (prężność) pary nasyconej – ciśnienie, przy którym w określonej temperaturze gaz jest w stanie równowagi z cieczą. Występuje wówczas równowaga między parowaniem i skraplaniem.
 W
WDestylacja ekstrakcyjna – jeden z rodzajów destylacji z użyciem czynnika rozdzielającego, czyli dodatkowego składnika, wprowadzanego do rozdzielanej mieszaniny w celu zmiany względnej lotności jej pierwotnych składników. Zwiększenie stosunku lotności umożliwia rozdzielenie mieszaniny lub ułatwia proces rozdzielania. W przypadku destylacji ekstrakcyjnej czynnik rozdzielający jest mało lotny. Opuszcza urządzenie do destylacji wraz z mniej lotnym składnikiem lub składnikami mieszaniny – z cieczą pozostającą po odpędzeniu składników lotnych. Do grupy procesów destylacji z użyciem czynnika rozdzielającego należy również destylacja azeotropowa i destylacja zeotropowa.
 W
WDestylacja prosta, destylacja różniczkowa, destylacja kotłowa – destylacja polegająca na jednorazowym odparowaniu i skropleniu cieczy. Jest to proces okresowy, w którym para powstająca w czasie wrzenia cieczy, zawierająca więcej związków niskowrzących, jest natychmiast odprowadzana z przestrzeni parowania. Powoduje to stopniowe zmiany składu układu gaz-ciecz, czyli obu współistniejących faz. Wskutek zmian składu pary odbierane są frakcje destylatu o różnej temperaturze wrzenia. Metoda nie umożliwia odzyskania składników w postaci czystej. Jest stosowana w przypadkach, gdy ich składniki znacząco różnią się lotnością.
 W
WEutektoid – drobnokrystaliczna mieszanina dwóch lub więcej faz przypominająca budową mieszaninę eutektyczną, ale powstała w stanie stałym.
 W
WEutektyka – mieszanina dwóch lub więcej faz o określonym składzie, która wydziela się z roztworów ciekłych w pewnej temperaturze, zwanej temperaturą eutektyczną. Mieszanina ta jest produktem przemiany eutektycznej. Nazwa wywodzi się z greckiego słowa eutektos, co znaczy „łatwo topliwy”.
 W
WFerryt – składnik fazowy i strukturalny stopów żelazo-węgiel, roztwór stały jednego lub więcej pierwiastków w żelazie α lub żelazie δ.
 W
WKawitacja – zjawisko fizyczne polegające na gwałtownej przemianie fazowej z fazy ciekłej w fazę gazową pod wpływem zmniejszenia ciśnienia. Jeżeli ciecz gwałtownie przyspiesza zgodnie z zasadą zachowania energii, ciśnienie statyczne cieczy musi zmaleć. Dzieje się tak np. w wąskim otworze przelotowym zaworu albo na powierzchni śruby napędowej statku. Kawitacja występuje wyłącznie w cieczach.
 W
WKriofor - szklane urządzenie, za pomocą którego można zaprezentować zjawisko parowania i wrzenia wody pod zmniejszonym ciśnieniem. Kriofor składa się z dwóch połączonych wygiętą rurką szklanych zbiorników. W jednym zbiorniku znajduje się trochę wody, resztę objętości wypełnia nasycona para wodna. Drugi, pusty zbiornik podczas pokazu jest zanurzany w mieszaninie oziębiającej lub w ciekłym azocie. W niskiej temperaturze para wodna zestala się (resublimuje) na wewnętrznych ściankach zbiornika, wskutek czego ciśnienie pary maleje. Przy intensywnym chłodzeniu można zaobserwować wrzenie wody, po pewnym czasie woda w zbiorniku zamarza. Woda wrze, ponieważ w niskiej temperaturze obniża się temperatura parowania, a zamarza dlatego, że na skutek znacznego obniżenia ciśnienia pary wodnej w zbiorniku, woda gwałtownie paruje, a parując, pobiera ciepło obniżając temperaturę wody aż dochodzi do krzepnięcia pozostałej wody.
 W
WKrzepnięcie – proces przechodzenia ciała ze stanu ciekłego w stan stały. Krzepnięcie wielu substancji zachodzi w określonej temperaturze zwanej temperaturą krzepnięcia. W miejscu styku substancji w stanie stałym i stanie ciekłym, w cieczy i w ciele stałym podczas krzepnięcia i topnienia panuje taka sama temperatura zwana temperaturą topnienia. Temperatura topnienia jest podawana jako wielkość charakterystyczna dla wielu substancji. Temperatura topnienia (krzepnięcia) zależy nieznacznie od ciśnienia. Procesowi towarzyszy wydzielanie ciepła, co jest równoważne temu, że krzepnięcie przy stałym ciśnieniu wymaga odprowadzenia ciepła z krzepnącej substancji.
 W
WKrzywa chłodzenia, krzywa stygnięcia, krzywa termograficzna – wykres zależności temperatury chłodzonego materiału od czasu. Jest to sposób graficznej prezentacji wyników bezpośredniej analizy termicznej stopów metali, prowadzonej w celu sporządzenia wykresów równowag fazowych, umożliwiających planowanie obróbki cieplnej. Jej planowanie polega na określeniu – dla każdego z etapów procesu – odpowiedniej temperatury, właściwej szybkości nagrzewania i chłodzenia oraz czasu wygrzewania lub studzenia. Właściwie przeprowadzona obróbka pozwala uzyskać metale o określonej strukturze i pożądanych właściwościach mechanicznych, na przykład:umocnione przez hartowanie, przesycanie roztworów stałych, utwardzanie wydzieleniowe, uplastycznione, na przykład przez odpuszczanie lub wyżarzanie.
 W
WLedeburyt – składnik strukturalny stopów żelazo-węgiel powstały w wyniku przemiany eutektycznej zawierający austenit i cementyt. Nazwa ledeburyt pochodzi od nazwiska jego odkrywcy, niemieckiego metalurga Karla Ledebura; profesora na Akademii Górniczej we Freibergu. Odkrycia dokonał w 1882 roku.
 W
WMartenzyt – pierwotnie nazwa jednej z metastabilnych struktur, występująca w stopach Fe-C, charakteryzująca się bardzo dużą twardością. Wywodzi się od nazwiska niemieckiego metalurga, Adolfa Martensa (1850–1914). Obecnie przez określenie martenzyt należy rozumieć wszystkie struktury, które powstają w wyniku szeroko rozumianych przemian martenzytycznych.
 W
WMieszalność cieczy jest zjawiskiem, które dotyczy cieczy o zbliżonych właściwościach, np. ciecze polarne mieszają się z innymi cieczami polarnymi, ciecze niepolarne mieszają się dobrze z innymi cieczami niepolarnymi.
 W
WNadkrytyczny dwutlenek węgla (scCO2) – płynna postać CO2 występująca w stanie nadkrytycznym, tj. dla temperatury i ciśnienia równych lub wyższych niż krytyczne (odpowiednio: 31 °C, 7,38 MPa)
 W
WNukleacja (zarodkowanie) – początkowy etap przemiany fazowej, podczas którego powstają w substancji niewielkie zarodki nowej fazy.
 W
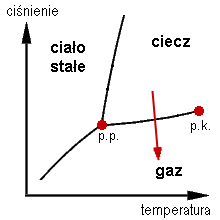
WObszar współistnienia – zestaw współrzędnych (fazowych) na wykresie fazowym, dla których współistnieją jakieś konkretne fazy. Współrzędnymi na wykresie fazowym są tzw. wielkości intensywne, jak ciśnienie, temperatura, stężenie.
 W
WParowanie (ewaporacja) – proces zmiany stanu skupienia, przechodzenia z fazy ciekłej danej substancji w fazę gazową (parę) zachodzący z reguły na powierzchni cieczy. Może odbywać się w całym zakresie ciśnień i temperatur, w których mogą współistnieć z sobą obie fazy.
 W
WPerytektoid (perytektoida) - składnik strukturalny stopów, faza powstająca w wyniku perytektoidalnej przemiany fazowej, która w układzie dwuskładnikowym zachodzi z udziałem trzech faz stałych. W warunkach izobarycznych ten trójfazowy układ jest zerozmienny. Perytektoid powstaje w czasie chłodzenia mieszaniny dwóch rodzajów kryształów istniejących przed przemianą, zwykle na ich powierzchni. Przemiana perytektoidalna kończy się, gdy układ odzyskuje jeden stopień swobody – zanika jedna z wyjściowych faz lub obie fazy wyjściowe. Przemiany perytektoidalne zachodzą np. w takich stopach, jak stopy miedzi z cyną, glinem lub krzemem.
 W
WPerytektyka (perytektyk) – składnik strukturalny stopów, faza powstająca w wyniku przemiany fazowej, która w układzie dwuskładnikowym zachodzi z udziałem fazy ciekłej (L) i dwóch faz stałych. W warunkach izobarycznych ten trójfazowy układ jest zerozmienny. Drugi rodzaj kryształów (perytektyka) powstaje w wyniku fazowej przemiany kryształów pierwszego rodzaju, zwykle na ich powierzchni. Przemiana perytektyczna kończy się, gdy układ odzyskuje jeden stopień swobody – zanika jedna z faz albo obie fazy wyjściowe.
 W
WPrzemiana austenityczna – przemiana jakiej doznaje nagrzewany ferryt powyżej temperatury 727 °C. Zachodzi wtedy przemiana ferrytu w austenit poprzez zarodkowanie heterogeniczne na granicach ziaren.
 W
WPrzemiana lambda – charakterystyczna przemiana fazowa helu zachodząca w pobliżu zera bezwzględnego. Jest to przemiana fazowa II rodzaju z fazy ciekłej helu I do fazy nadciekłej helu II.
 W
WPrzemiana martenzytyczna – przemiana fazowa pierwszego rodzaju zachodzącą mechanizmem bezdyfuzyjnym, której produktem jest struktura nazywana martenzytem.
 W
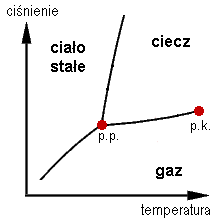
WPunkt krytyczny, warunki krytyczne – punkt przejścia układu fizycznego w stan o odmiennych właściwościach, w którym nie można rozróżnić obu stanów. Na przykład:dla substancji czystych punkt krytyczny oznacza temperaturę krytyczną, powyżej której nie można skroplić gazu, niezależnie od wielkości ciśnienia. Jest to punkt krytyczny dwuwymiarowy. Parametry krytyczne oznacza się często dolnymi indeksami „kr”, „k”, „cr” lub „c”, czasami z dodatkiem „2D” („2”), „3D” („3”) itd., w zależności od tego, jakiego układu dotyczą, na przykład T3c. Dla gazów parametry krytyczne można określić na podstawie współczynników odpowiedniego równania stanu, na przykład równania van der Waalsa. w przypadku gazów zaadsorbowanych na powierzchni, jak i innych zjawisk związanych z dwoma wymiarami (2D), warunki krytyczne będą się różniły. Wiele przejść fazowych również zachodzi jedynie w warunkach powyżej lub poniżej pewnych wartości krytycznych. punkt krytyczny dla ciekłych układów wieloskładnikowych oznacza stan, w którym zanika różnica między współistniejącymi fazami ciekłymi – dla wielu mieszanin ciekłych istnieją obszary, w których istnieje całkowita mieszalność, i obszary, gdzie istnieje ograniczenie rozpuszczalności, a więc w pewnym zakresie stężeń współistnieją odrębne fazy.
 W
WPunkt krytyczny wody – temperatura, powyżej której nie występuje faza ciekła wody, a substancja ta występuje tylko w stanie gazowym. W stanie krytycznym ciepło parowania oraz napięcie powierzchniowe wody są równe zeru. W temperaturze powyżej krytycznej niemożliwe jest skroplenie wody, bez względu na ciśnienie.
 W
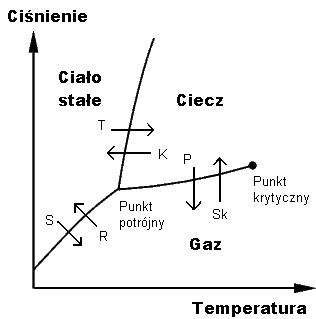
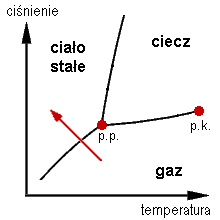
WPunkt potrójny – stan, w jakim dana substancja może istnieć w trzech fazach termodynamicznych równocześnie w równowadze termodynamicznej. Punkt ten określony jest przez temperaturę i ciśnienie punktu potrójnego. Na diagramie fazowym, ukazującym zależności ciśnienia od temperatury stanów równowagi faz, jest to punkt przecięcia krzywych równowagi fazowej substancji odpowiadający stanowi równowagi trwałej trzech stanów skupienia.
 W
WReguła dźwigni – zasada interpretacji wykresów fazowych, umożliwiająca określanie udziałów dwóch faz znajdujących się w stanie równowagi w obszarach współistnienia. Użycie pojęcia "dźwignia" wskazuje analogię do klasycznej dźwigni – podstawowej maszyny prostej, która znajduje się w równowadze mechanicznej, gdy są sobie równe iloczyny siły (F) przez długość ramienia (r).
 W
WResublimacja, desublimacja – przemiana fazowa polegająca na bezpośrednim przechodzeniu substancji z fazy gazowej (pary) w fazę stałą z pominięciem stanu ciekłego. Resublimacja jest procesem odwrotnym do sublimacji. W wyniku resublimacji wody powstaje szron i śnieg. Resublimacja, w połączeniu z sublimacją lub parowaniem, jest wykorzystywana do oczyszczania lub rozdzielania substancji i otrzymywania ich w postaci krystalicznej.
 W
WRównanie Avramiego – równanie opisujące kinetykę izotermicznej krystalizacji sferolitycznej. Charakteryzuje ono zmianę w czasie ułamka wykrystalizowanej substancji w stosunku do całości substancji. Zostało ono sformułowane pod koniec lat trzydziestych XX w. w różnych postaciach, niezależnie przez kilku badaczy, ale spopularyzował je Melvin Avrami, dlatego nazywane jest jego imieniem.
 W
WRównanie Clausiusa-Clapeyrona – równanie opisujące zależność między zmianą ciśnienia a zmianą temperatury wzdłuż krzywej fazowej dla przemiany fazowej układu jednoskładnikowego:
 W
WSkraplanie lub kondensacja – zjawisko zmiany stanu skupienia, przejścia substancji z fazy gazowej w fazę ciekłą. Przeciwieństwo parowania.
 W
WStan nadkrytyczny – stan substancji, w którym temperatura i ciśnienie są większe od ciśnienia i temperatury jej punktu krytycznego.
 W
WStop żelaza z węglem – stopy, w których węgiel rozpuszczany jest w żelazie. Węgiel może występować w nich w postaci węgla czystego – grafitu, roztworu stałego w sieci krystalicznej ferrytu lub austenitu albo jako węglik żelaza, np. Fe3C, zwanego cementytem.
 W
WSublimacja – przemiana fazowa bezpośredniego przejścia ze stanu stałego w stan gazowy z pominięciem stanu ciekłego. Zjawisko odwrotne do sublimacji to resublimacja.
 W
WSuperkawitacja – zjawisko fizyczne polegające na powstaniu wokół obiektu zanurzonego w cieczy bąbla gazowego otaczającego cały ten obiekt. Może się tak zdarzyć np. gdy emituje on wibracje lub porusza się z dużą prędkością względem cieczy.
 W
WTemperatura topnienia – temperatura, w której kryształ zamienia się w ciecz.
 W
WTopnienie – przemiana fazowa polegająca na przejściu substancji ze stanu stałego w stan ciekły.
 W
WWrzenie – zjawisko przemiany cieczy w gaz (parę), podczas którego powstają i rosną pęcherzyki pary nasyconej w objętości cieczy. Wrzenie jest więc gwałtownym parowaniem nie tylko na powierzchni, ale także w całej objętości. Wrzenie wymaga dostarczania energii do wrzącego ciała, dlatego jest przejściem fazowym pierwszego rodzaju i jest procesem endotermicznym.
 W
WWykres fazowy – dla różnych faz pozostających w stanie równowagi – zależność składu danej fazy od składu innej fazy; wykres taki zawiera informację na temat obszarów lub punktów współistnienia, w których istnieją jednocześnie różne fazy.
 W
WWykres fazowy Al-Ni - jest to wykres równowagowy aluminium w stopie z niklem. Wykres informuje, jaką strukturę posiada stop, przy równowagowym procesie wytwarzania.
 W
WZeotrop – taki układ ciecz–para, w którym skład ciekłej mieszaniny (roztworu) dwóch lub więcej związków chemicznych jest zawsze inny niż skład pary nasyconej, powstającej z tej cieczy. Na wykresach fazowych prężność pary–skład (izotermy) i temperatura–skład (izobary), ilustrujących warunki równowagi termodynamicznej, nie występują punkty ekstremalne, charakterystyczne dla azeotropów dodatnich i ujemnych. Jest to konsekwencją występowania niewielkich odchyleń od prawa Raoulta, dotyczącego roztworów doskonałych.
 W
WZjawisko Leidenfrosta – zjawisko dotyczące opóźnionego parowania cieczy, opisane i wyjaśnione przez niemieckiego lekarza, fizyka i chemika Johanna Leidenfrosta w roku 1756.