 W
WReakcja Achmatowicza – droga syntezy dihydropiranu z furanu, opracowana i opublikowana w 1971 r. przez polskiego chemika Osmana Achmatowicza (syna).
 W
WReakcja Appela – reakcja w chemii organicznej, w której alkohol reaguje z czterochlorkiem węgla w obecności trifenylofosfiny, tworząc odpowiedni chlorek alkilowy. Użycie czterobromku węgla, bromu lub bromku litu jako źródła jonów bromkowych pozwala otrzymać odpowiedni bromek alkilowy, podobnie reakcja z jodkiem metylu lub jodem daje jodek alkilowy. Reakcja ta została nazwana od nazwiska Rolfa Appela (1921–2012), jednak została ona opisana wcześniej.
 W
WUtlenianie Baeyera-Villigera – reakcja chemiczna polegająca na utlenianiu ketonów do estrów za pomocą nadkwasów lub nadtlenku wodoru. Największą zaletą tej reakcji jest jej stereospecyficzność oraz regioselektywność. Nazwa pochodzi od nazwisk odkrywców, chemików: Johanna Friedricha Wilhelma Adolfa von Baeyera (1835–1917) niemieckiego pochodzenia oraz Victora Villigera (1868–1934) pochodzenia szwedzkiego.
 W
WPrzegrupowanie Beckmanna - reakcja chemiczna przegrupowania oksymów do amidów katalizowana przez kwasy. Została odkryta przez niemieckiego chemika Ernsta Otto Beckmanna w 1886 r. Cykliczne oksymy przegrupowują do laktamów.
 W
WPróba Benedicta – reakcja chemiczna, która służy do wykrywania większości cukrów i aldehydów. Metoda została opublikowana przez Stanleya Benedicta w roku 1909.
 W
WMetoda Bergiusa - katalityczne uwodornianie pod ciśnieniem wysokowrzących olei, smoły, oraz węgla brunatnego w celu otrzymania benzyny syntetycznej.
 W
WReakcja Biełousowa-Żabotyńskiego – oscylacyjna reakcja chemiczna występująca w wodnym roztworze w temperaturze pokojowej, w której występują okresowe zmiany barwy roztworu z okresem około jednej minuty.
 W
WReakcja Boudouarda – reakcja redoks mieszaniny tlenku węgla i dwutlenku węgla, pozostającej w równowadze chemicznej w danej temperaturze, polegająca na dysproporcjonowaniu tlenku węgla do dwutlenku węgla oraz grafitu:2 CO ⇌ CO2 + C
 W
WReakcja Dielsa-Aldera - reakcja chemiczna polegająca na skoordynowanej cykloaddycji podstawionego alkenu do sprzężonego dienu. Produktem tej reakcji jest węglowodór cykliczny. Reakcja ta w podwyższonych temperaturach, w fazie gazowej zachodzi spontanicznie bez potrzeby stosowania katalizatorów.
 W
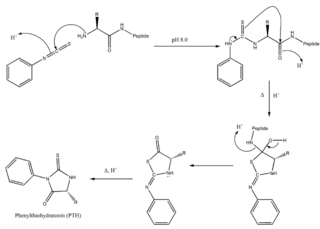
WDegradacja Edmana - metoda sekwencjonowania peptydów polegająca na kolejnym odrywaniu oznakowanych aminokwasów z N-końca cząsteczki peptydu. Opracowana w roku 1950 przez szwedzkiego biochemika Pehr Edman.
 W
WSynteza Fischera-Tropscha – katalityczna reakcja chemiczna tworzenia węglowodorów z mieszaniny tlenku węgla i wodoru, czyli tak zwanego gazu syntezowego. Celem syntezy F-T jest produkcja paliw płynnych. Jedną z zalet syntezy F-T jest możliwość wytwarzania paliwa wolnego od związków siarki i azotu, a przez to czystszego dla środowiska naturalnego.
 W
WZegar jodowy – autokatalityczna reakcja chemiczna, podczas której początkowo bezbarwny roztwór po pewnym czasie w mgnieniu oka zmienia kolor na granatowo-czarny. Po raz pierwszy opisana została przez Hansa Landolta, później jej kinetyka badana była przez Augustusa Harcourta (1834–1919) i Williama Essona (1838–1916).
 W
WReakcja Iwanowa – reakcja chemiczna odkryta przez bułgarskiego naukowca, prof. Dimityra Iwanowa. Jest to reakcja arylopochodnych kwasu octowego ze związkami Grignarda, a następnie ze związkami elektrofilowymi, najczęściej związkami karbonylowymi, izocyjanianami lub halogenkami alkilowymi. W reakcji Iwanowa z aldehydami i ketonami powstają kwasy β-hydroksykarboksylowe lub α,β-nienasycone kwasy karboksylowe.
 W
WMetoda Kjeldahla – metoda oznaczania azotu amonowego i aminowego, np. występującego w wodzie, glebie lub produktach spożywczych. Przy jej zastosowaniu azot związany w związkach organicznych jest przekształcany w postać amonową (mineralizowany) i analizowany łącznie ze związkami amonowymi obecnymi w próbce. Suma azotu amonowego i organicznego (nieazotanowego) jest określana w hydrochemii jako azot Kjeldahla lub azot ogólny.
 W
WReakcja Kostaneckiego jest stosowaną w syntezie organicznej metodą otrzymywania kromonów oraz pochodnych kumaryny, polegającą na acylowaniu ketonów o-hydroksyarylowych, po którym następuje cyklizacja. Reakcję na przełomie XIX i XX wieku opracował Stanisław Kostanecki:
 W
WZegar jodowy – autokatalityczna reakcja chemiczna, podczas której początkowo bezbarwny roztwór po pewnym czasie w mgnieniu oka zmienia kolor na granatowo-czarny. Po raz pierwszy opisana została przez Hansa Landolta, później jej kinetyka badana była przez Augustusa Harcourta (1834–1919) i Williama Essona (1838–1916).
 W
WMetoda Leblanca – metoda otrzymywania węglanu sodu na skalę przemysłową opracowana w 1791 przez Nicolasa Leblanca. Proces ten polega na wykorzystaniu ciągu reakcji chemicznych.
 W
WPróba Lucasa – reakcja chemiczna alkoholi z kwasem solnym w obecności chlorku cynku, której szybkość pozwala na określenie rzędowości badanego alkoholu.
 W
WReakcja Maillarda – seria reakcji chemicznych, które zachodzą najczęściej pod wpływem ciepła, pomiędzy aminokwasami a cukrami redukującymi.
 W
WReakcja Mitsunobu – reakcja chemiczna alkoholi z odpowiednim czynnikiem nukleofilowym w obecności trifenylofosfiny oraz estru etylowego (DEAD) lub izopropylowego (DIAD) kwasu azodikarboksylowego. W zależności od użytego odczynnika nukleofilowego grupa hydroksylowa ulega przekształceniu w odpowiednią grupę funkcyjną, np. estrową. Reakcja zachodzi z inwersją (zmianą) konfiguracji. Została odkryta przez Oyo Mitsunobu w 1967 roku.
 W
WPrzegrupowanie Nebera – reakcja chemiczna, w której oksymy przekształcają się w α-aminoketony pod wpływem działania chlorku tosylu.
 W
WReakcja Petersona - reakcja chemiczna między karboanionem z grupą sililową w pozycji α a ketonami lub aldehydami w wyniku której tworzy się w pierwszym etapie β-hydroksysilan, który następnie ulega spontanicznej eliminacji z utworzeniem alkenu.
 W
WReakcja biuretowa (reakcja Piotrowskiego) – charakterystyczna reakcja chemiczna pozwalająca na wykrywanie wiązań peptydowych w rozmaitych związkach organicznych, głównie w białkach i peptydach. Warunkiem koniecznym dla pozytywnego wyniku próby jest występowanie co najmniej dwóch wiązań peptydowych bezpośrednio obok siebie lub przedzielonych nie więcej niż jednym atomem węgla. Nazwa testu pochodzi od najprostszego związku, który ulega tej reakcji, a mianowicie biuretu, czyli dimeru mocznika (NH2CONHCONH2).
 W
WReakcja Sandmeyera – reakcja chemiczna wykorzystywana do syntezy halogenków arylowych z arylowych soli diazoniowych. Nazwa pochodzi od nazwiska odkrywcy, szwajcarskiego chemika Traugotta Sandmeyera.Przebieg reakcji:
 W
WAsymetryczna aminohydroksylacja Sharplessa - reakcja chemiczna olefin z tetratlenkiem osmu i solą odpowiedniego amidu, sulfonamidu lub karbaminianu w obecności chiralnego ligandu chininowego, której produktem są wicynalne 1,2-aminoalkohole.
 W
WAsymetryczna dihydroksylacja Sharplessa – reakcja chemiczna olefin z tetratlenkiem osmu (OsO4) w obecności chiralnego ligandu chininowego, której produktami są wicynalne diole.
 W
WAsymetryczna epoksydacja Sharplessa - enancjoselektywna reakcja chemiczna alkoholi allilowych z wodoronadtlenkiem tert-butylu wobec odpowiedniego enancjomeru winianu dietylu (DET) oraz izopropanolanu tytanu Ti(OiPr)4, której produktem są 2,3-epoksyalkohole.
 W
WMetoda Solvaya – metoda otrzymywania węglanu sodu opracowana w latach 60. XIX w. przez Ernesta Solvaya. Proces ten polega na wykorzystaniu ciągu następujących reakcji chemicznych:CaCO3 → CaO + CO2, NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl, 2NaHCO3 → Na2CO3 + CO2 + H2O – (kalcynacja), 2NH4Cl + CaO → 2NH3 + H2O + CaCl2,
 W
WPróba Tollensa – reakcja chemiczna służąca do wykrywania aldehydów. Podczas pozytywnej próby Tollensa powstaje srebro metaliczne, osadzające się w postaci lustrzanej powłoki na szklanej powierzchni naczynia reakcyjnego. Ketony dają negatywny wynik próby, z wyjątkiem cukrów z grupy ketoz, takich jak fruktoza.
 W
WSynteza Wöhlera – reakcja chemiczna polegająca na konwersji amoniaku do mocznika. Odkrycie tej reakcji w 1828 r. stanowiło przełom, który współcześnie jest uważany za początek nowożytnej chemii organicznej.