 W
WAmoniak, NH3 – nieorganiczny związek chemiczny azotu i wodoru.
 W
WAntymonowodór, SbH3 – nieorganiczny związek chemiczny antymonu i wodoru. Bezbarwny, toksyczny gaz o nieprzyjemnym zapachu. Ogrzewany rozkłada się na pierwiastki składowe.
 W
WArsenowodór, AsH3 – nieorganiczny związek chemiczny, bezbarwny, piroforyczny, silnie trujący gaz o zapachu czosnku. Słabo rozpuszcza się w wodzie. Ogrzewany rozkłada się na arsen i wodór.
 W
WAzotowodór zwany też kwasem azotowodorowym – nieorganiczny związek chemiczny o wzorze HN3, bezbarwna, łatwo parująca, toksyczna ciecz, silnie wybuchowa. Gazowy azotowodór także wykazuje działanie wybuchowe.
 W
WBizmutowodór, BiH3 – nieorganiczny związek chemiczny, powstaje w śladowych ilościach w wyniku działania kwasu solnego na stop bizmutu z magnezem. W temperaturze pokojowej rozkłada się na pierwiastki.
 W
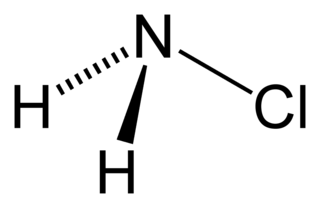
WChloroamina, NH2Cl – nieorganiczny związek chemiczny, toksyczny gaz tworzący się w reakcji amoniaku i podchlorynu sodu.
 W
WCyjanowodór, HCN – nieorganiczny związek chemiczny zbudowany z wodoru, węgla i azotu, będący bezbarwną, lotną i silnie trującą cieczą o zapachu gorzkich migdałów. Z wodą tworzy słaby kwas cyjanowodorowy, którego sole noszą nazwę cyjanków. Znalazł zastosowanie w syntezie i analizie chemicznej oraz jako pestycyd. W czasie II wojny światowej był stosowany pod nazwą Cyklon B do trucia więźniów w niemieckich obozach zagłady. Zalicza się go do ogólnotrujących bojowych środków trujących i jest wpisany do wykazu 3. Konwencji o zakazie broni chemicznej.
 W
WCynowodór, SnH4 – nieorganiczny związek chemiczny, połączenie cyny i wodoru.
 W
WDekaboran – nieorganiczny związek chemiczny z grupy borowodorów.
 W
WDiboran, B2H6 – nieorganiczny związek chemiczny, dimer borowodoru. Jest wysoce reaktywny, z powietrzem tworzy mieszaninę wybuchową, łatwo ulega samozapłonowi pod wpływem wilgoci. Ciśnienie pary nasyconej wynosi 28 bar (0 °C).
 W
WDifosfina, P2H4 – nietrwały nieorganiczny związek chemiczny, połączenie fosforu i wodoru o budowie chemicznej analogicznej do hydrazyny. Jest bezbarwną cieczą ulegającą spontanicznemu zapłonowi w powietrzu. Zawartość difosfiny w fosfinie jest przyczyną jej samozapłonu w powietrzu o temperaturze pokojowej. Difosfina posiada charakterystyczny zapach zgniłych ryb – wyczuwalny nawet przy bardzo niskich stężeniach.
 W
WFluorowodorek argonu, HArF – nieorganiczny związek chemiczny argonu, będący pierwszym znanym związkiem tego pierwiastka. Został otrzymany przez zespół fińskich chemików kierowany przez Markku Räsänena, a jego odkrycie zostało opublikowane 24 sierpnia 2000 roku. Związek nie został wyizolowany w postaci czystej i był badany metodami obliczeniowymi oraz spektroskopowymi w matrycy z zestalonego argonu.
 W
WFluorowodorek kryptonu, HKrF – nieorganiczny związek chemiczny kryptonu, wodoru i fluoru. Istnienie stabilnej cząsteczki HKrF zostało przewidziane na drodze modelowania, a następnie związek został otrzymany przez zespół fińskich chemików kierowany przez Markku Räsänena w 2001 roku. Związek nie został wyizolowany w postaci czystej i był badany metodami obliczeniowymi oraz spektroskopowymi w matrycy z zestalonego kryptonu.
 W
WFosforowodór, fosforiak, fosfina, PH3 – nieorganiczny związek chemiczny, którego cząsteczka zbudowana jest z fosforu i wodoru. Jest to bezbarwny, palny i bardzo toksyczny gaz.
 W
WHydrazyna, diazan, N2H4 – nieorganiczny związek chemiczny zbudowany z dwóch połączonych ze sobą wiązaniem N−N grup aminowych. Jest to silnie trująca, bezbarwna, łatwopalna, żrąca, higroskopijna ciecz, dymiąca na powietrzu.
 W
WHydroksyloamina – nieorganiczny związek chemiczny, pochodna amoniaku, w której jeden atom wodoru został zastąpiony grupą hydroksylową. Najprostsza hydroksyamina.
 W
WKrzemowodory, związki krzemu z wodorem o wzorze ogólnym SinH2n+2, krzemowe analogi nierozgałęzionych alkanów. Nazywane również silanami lub zaliczane do nich jako podgrupa, wraz ze związkami zawierającymi grupy alkilowe oraz inne podstawniki.
 W
WKwas fluoroantymonowy, [H2F]+[SbF6]− – nazwa stosowana dla mieszaniny fluorowodoru (HF) i pentafluorku antymonu w różnych stosunkach. Uważany jest za najsilniejszy superkwas. Reakcja jego tworzenia przebiega następująco:SbF5 + 2HF ⇄ SbF−6 + H2F+
 W
WKwas piorunowy, HCNO – nieorganiczny związek chemiczny, izomer kwasu cyjanowego (HOCN) i izocyjanowego (HNCO). Istnieje tylko w wodnym roztworze. Jest reaktywny, ulega addycji i polimeryzacji.
 W
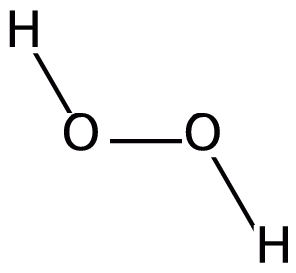
WNadtlenek wodoru (H2O2) – nieorganiczny związek chemiczny z grupy nadtlenków, jedna z reaktywnych form tlenu. Otrzymany został po raz pierwszy przez Louisa Thénarda w 1818 roku w reakcji nadtlenku baru z kwasem azotowym.
 W
WPolisulfany (polisiarczki wodoru, wodorki polisiarki) – grupa nieorganicznych związków chemicznych zbudowanych z nierozgałęzionych łańcuchów atomów siarki zakończonych atomami wodoru o wzorze ogólnym HSnH (n ≥ 2). Czasami disulfan (HS2H) nie jest uwzględniany w tej grupie.
 W
WSelenowodór, H2Se – nieorganiczny związek chemiczny selenu i wodoru; palny, silnie trujący gaz, o charakterystycznym ostrym zapachu.
 W
WSiarkowodór (sulfan), H2S – nieorganiczny związek chemiczny z grupy wodorków kowalencyjnych, połączenie siarki i wodoru. W warunkach normalnych jest to bezbarwny, palny gaz, którego silny, charakterystyczny zapach zgniłych jaj jest wyczuwalny w bardzo niewielkich stężeniach. Próg wyczuwalności siarkowodoru w powietrzu to od 0,0007 do 0,2 mg/m³. Powyżej 4 mg/m³ zapach jest odczuwany jako bardzo silny, jednak przy jeszcze wyższych stężeniach, przekraczających 300 mg/m³ staje się niewyczuwalny z powodu natychmiastowego porażenia nerwu węchowego. Siarkowodór jest silnie trujący. Jako stężenie niebezpieczne dla zdrowia przyjmuje się 6 mg/m³. Stężenie 100 mg/m³ powoduje uszkodzenie wzroku, natomiast przy stężeniu powyżej 1 g/m³ śmierć może nastąpić już w wyniku zaczerpnięcia jednego oddechu. Niebezpieczeństwo zatrucia siarkowodorem zachodzi m.in. podczas prac związanych z opróżnianiem szamba, wierceniem i kopaniem studni, wchodzeniem do studni, studzienek kanalizacyjnych lub niewentylowanych korytarzy podziemnych.
 W
WTellurowodór (tellan), H2Te – nieorganiczny związek chemiczny telluru i wodoru. Rozpuszczony w wodzie tworzy kwas tellurowodorowy.
 W
WWoda (tlenek wodoru; nazwa systematyczna IUPAC: oksydan) – związek chemiczny o wzorze H2O, występujący w warunkach standardowych w stanie ciekłym. W stanie gazowym wodę określa się mianem pary wodnej, a w stałym stanie skupienia – lodem. Słowo „woda” jako nazwa związku chemicznego może się odnosić do każdego stanu skupienia.
 W
WTlenki wodoru – grupa nieorganicznych związków chemicznych zbudowanych z tlenu i wodoru.H2O: oksydan, tlenek wodoru, woda H2O2: dioksydan, nadtlenek wodoru, nadtlenek diwodoru – substancja żrąca, utleniacz; H2O3: trioksydan, tritlenek diwodoru, trójtlenek wodoru – związek nietrwały
 W
WTritlenek diwodoru (trioksydan), H2O3 – nietrwały nieorganiczny związek chemiczny.
 W
WWoda (tlenek wodoru; nazwa systematyczna IUPAC: oksydan) – związek chemiczny o wzorze H2O, występujący w warunkach standardowych w stanie ciekłym. W stanie gazowym wodę określa się mianem pary wodnej, a w stałym stanie skupienia – lodem. Słowo „woda” jako nazwa związku chemicznego może się odnosić do każdego stanu skupienia.