 W
WDiagram Grotriana – obrazowe przedstawienie degeneracji poziomów energetycznych elektronu w atomie. Diagram Grotriana zawiera w sposób symboliczny informacje o:poziomach energetycznych w atomie głównej liczbie kwantowej n pobocznej liczbie kwantowej l dozwolonych przejściach pomiędzy stanami atomu
 W
WEfekt Augera (samojonizacja) – zjawisko emisji elektronów przez atom, zachodzące dzięki energii uwolnionej na skutek wypełniania luk w niskich powłokach elektronowych przez elektrony z wyższych powłok. Luki te mogą powstawać na skutek wychwytu elektronu z wewnętrznej powłoki przez jądro. Przyczyną pojawienia się luk na niższych powłokach może być również wybicie elektronu przez inną cząstkę, kwant promieniowania rentgenowskiego lub promieniowania γ.
Efekt Zeemana – zjawisko fizyczne, które polega na rozszczepieniu obserwowanych linii spektralnych na składowe, gdy próbka emitująca promieniowanie zostaje umieszczona w polu magnetycznym.
 W
WW optyce emisja wymuszona – proces emisji fotonów przez materię w wyniku oddziaływania z fotonem inicjującym. Warunkiem do tego, aby emisja wymuszona nastąpiła, jest równość energii fotonu z energią wzbudzenia atomu. Foton inicjujący emisję nie jest pochłaniany przez materię – pełni tylko rolę wyzwalającą proces. Foton emitowany przez atom ma częstotliwość, fazę i polaryzację taką samą jak foton wywołujący emisję. Kierunek ruchu obu fotonów również jest ten sam. Światło złożone z takich identycznych fotonów nazywa się światłem spójnym. Zjawisko to jest podstawą działania laserów.
 W
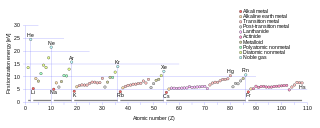
WEnergia jonizacji, potencjał jonizacyjny atomu lub cząsteczki – minimalna energia, którą należy dostarczyć, aby oderwać elektron od atomu danego pierwiastka lub cząsteczki. Przy jonizacji atomu znajdującego się w stanie podstawowym używa się określenia „pierwszy potencjał jonizacyjny”; przy odrywaniu kolejnych elektronów mówi się o drugim, trzecim, n-tym potencjale jonizacyjnym, określając w ten sposób energię potrzebną do oderwania n-tego elektronu po wcześniejszym oderwaniu n−1 elektronów.
 W
WFotoluminescencja – rodzaj luminescencji, emisja promieniowania elektromagnetycznego przez atomy, cząsteczki lub ciała stałe w wyniku pochłonięcia przez nie energii świetlnej z obszaru widzialnego, ultrafioletu lub podczerwieni.
 W
WGaz jednoatomowy – gaz złożony z pojedynczych atomów.
 W
WLene Vestergaard Hau – duńska fizyk, która wraz ze swoim zespołem na Uniwersytecie Harvarda przeprowadziła doświadczenia mające na celu spowolnienie, a następnie zatrzymanie promieni światła.
 W
WKondensacja Bosego-Einsteina – efekt kwantowy zachodzący w układach podległych rozkładowi Bosego-Einsteina. W temperaturach niższych od temperatury krytycznej część cząstek (bozonów) przechodzi w zerowy stan pędowy – cząstki te mają identyczny pęd. Oznacza to, że w zerowej objętości przestrzeni pędów może znajdować się niezerowa liczba cząstek. Mówi się wtedy o makroskopowym obsadzeniu stanu podstawowego.
 W
WKwadrupol – obiekt posiadający moment kwadrupolowy, a nie posiadający wyższych momentów.
 W
WWzór Larmora – wzór określający całkowitą moc wypromieniowaną przez nierelatywistyczny punkt posiadający ładunek elektryczny, kiedy przyspiesza bądź zwalnia. Znajduje zastosowanie w dziedzinie fizyki zwanej elektrodynamiką; nie dotyczy natomiast innego zjawiska nazwanego od tego samego uczonego, precesji Larmora w zjawisku klasycznego rezonansu magnetycznego. Wzór ten został wprowadzony po raz pierwszy przez J.J. Larmora w 1897 roku w kontekście teorii falowej natury światła.
 W
WModel budowy atomu Bohra – model atomu wodoru autorstwa Nielsa Bohra opracowany w 1913 roku. Bohr przyjął wprowadzony przez Ernesta Rutherforda model atomu, według którego elektron krąży wokół jądra jako naładowany punkt materialny, przyciągany przez jądro siłami elektrycznymi.
 W
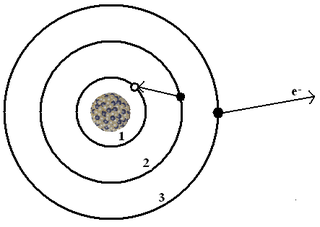
WModel atomu Rutherforda – opublikowany w 1911 roku model atomu opracowany przez Ernesta Rutherforda.
 W
WModel atomu Thomsona, zwany także modelem "'ciasta z rodzynkami" – model atomu zaproponowany przez brytyjskiego fizyka J. J. Thomsona. W modelu tym Thomson założył, że każdy atom jest zbudowany z jednorodnej kuli naładowanej dodatnio, wewnątrz której znajdują się ujemnie naładowane elektrony. Za pomocą tego modelu, mającego obecnie znaczenie tylko historyczne, próbowano w sposób klasyczny wyjaśnić budowę atomu.
 W
WOrbital p – taki orbital, czyli falowa funkcja własna elektronu w polu oddziaływania jądra lub rdzenia atomowego, która odpowiada pobocznej liczbie kwantowej Od wartości głównej liczby kwantowej zależy energia elektronu, a od wartości magnetycznej liczby kwantowej – funkcja rozkładu określająca „gęstość ładunku” w różnych punktach otoczenia jądra. Orbitale mają formę wzajemnie prostopadłych „obrotowych ósemek”, łącznie wypełniających sferę wokół jądra. Radialny rozkład gęstości cechują maksima. Najwyższe z nich występuje w odległości od jądra zbliżonej do wartości promienia odpowiedniej orbity Bohra.
 W
WOrbital s – orbital, czyli falowa funkcja własna elektronu w polu oddziaływania jądra lub rdzenia atomowego, który odpowiada pobocznej liczbie kwantowej Energia elektronu na orbitalu jest zależna od wartości głównej liczby kwantowej, Wartości funkcji falowej w różnych punktach sferycznej chmury elektronowej otaczającej ładunek centralny nie zależą od kierunku promienia sfery. Charakter ich zależności od odległości od centrum jest różny dla różnych liczb kwantowych Najbardziej prawdopodobne jest znalezienie elektronu w takiej odległości od jądra, która jest zbliżona do promienia odpowiedniej orbity Bohra.
 W
WPowłoka elektronowa – zbiór stanów kwantowych o tej samej wartości głównej liczby kwantowej.
 W
WPoziom energetyczny – energia stanu dostępnego dla cząstki. Poziom może być zdegenerowany, jeśli dana wartość energii cechuje więcej niż jeden stan kwantowy.
 W
WPromieniowanie charakterystyczne – linie spektralne atomów charakterystyczne dla danego pierwiastka, powstające po wybiciu elektronu z wewnętrznej powłoki elektronowej i następującego po tym przejściu innego elektronu z powłoki wyższej na zwolnione miejsce. Po wybiciu elektronu z powłoki wewnętrznej atom ma większą energię, niż gdy ma wypełnione powłoki. Elektron przechodząc na poziom o mniejszej energii, może utracić ją w wyniku promieniowania elektromagnetycznego o energii równej różnicy energii między tymi poziomami.
 W
WPrzesunięcie Lamba lub przesunięcie poziomów Lamba – niewielka rozbieżność między obserwowanymi doświadczalnie poziomami energetycznymi atomów wodoru a przewidywaniami równania Diraca, odkryta w 1947-1952 przez Willisa Lamba i jego studenta Roberta C. Retherforda.
 W
WRadioizotopowy generator termoelektryczny, radioizotopowa bateria termoelektryczna – generator prądu elektrycznego, w którym źródłem energii jest rozpad izotopu promieniotwórczego, a wydzielone w ten sposób ciepło zamieniane jest na energię elektryczną.
 W
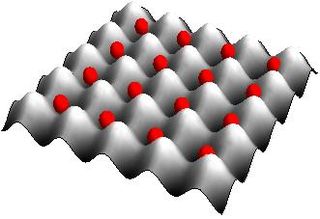
WSieć optyczna jest formowana za pomocą interferujących wiązek laserowych, które tworzą falę stojącą. Powoduje ona powstanie efektywnego okresowego potencjału oddziaływania widzianego przez neutralne atomy na skutek istnienia tzw. zmiennopolowego efektu Starka. Atomy są chłodzone, gaz ma największą gęstość w okolicach minimów potencjału. Potencjał okresowy widziany przez neutralne atomy przypomina sieć krystaliczną metali.
 W
WSpowalnianie Zeemana - metoda spowalniania atomów w wiązce atomowej o prędkościach rzędu kilkuset m/s do prędkości mniejszych niż 10 m/s w celu osiągnięcia ultrazimnych atomów. Spowalnianie wiązki atomów wykorzystuje przeciwbieżną wiązkę lasera o stałej częstotliwości, która poprzez oddziaływanie rezonansowe wywiera ciśnienie promieniowania na atomy. Technika ta zalicza się do chłodzenia laserowego. Atomy poruszające się z coraz mniejszą prędkością przestają oddziaływać z laserem chłodzącym na skutek efektu Dopplera. Odstrojenie to kompensowane jest przy użyciu niejednorodnego przestrzennie pola magnetycznego, dzięki czemu atomy pozostają dostrojone do rezonansu z przeciwbieżną wiązka lasera, a tym samym dalej spowalniane.
 W
WTeoria atomistyczna Daltona – opublikowany w 1808 roku przez angielskiego uczonego Johna Daltona model budowy materii. Dalton przyjął, że jest ona zbudowana z atomów, będących niepodzielnymi, sprężystymi kulami.
 W
WUltrazimne atomy – termin używany do opisania gazu atomów o temperaturach bliskich 0 kelwina. Za graniczną temperaturę poniżej, której układ nazywamy ultrazimnym przyjmuje się 1 mK, podczas gdy zimnym nazywamy gaz, którego temperatura jest mniejsza niż 1 K. Temperatury otrzymywanych powszechnie w laboratoriach ultrazimnych gazów atomów mieszczą się pomiędzy 1 μK a 1 nK, przy czym udało się również otrzymać gazy o temperaturach poniżej 500 pK (500 × 10−12K). W tak niskich temperaturach klasyczny opis gazów zawodzi, ponieważ zjawiska kwantowe zaczynają odgrywać dominującą rolę, a co za tym idzie, do poprawnego opisu badanych układów należy używać mechaniki kwantowej. Kwantowa natura w reżimie ultraniskich temperatur przejawia się m.in. występowaniem kondensacji Bosego-Einsteina w przypadku atomów bozonowych lub zdegenerowanych gazów Fermiego, kiedy atomy są fermionami. Gazy ultrazimnych atomów znalazły też zastosowania w optyce nieliniowej, dokładnych pomiarach kwantowych właściwości pojedynczych atomów, inżynierii stanów kwantowych, precyzyjnej spektroskopii i zegarach atomowych.
 W
WZegar atomowy – rodzaj zegara, którego działanie opiera się na zliczaniu okresów atomowego wzorca częstotliwości.