 W
WCeruloplazmina – enzym z grupy α2-globulin, zawierający w swojej strukturze 6 atomów miedzi. Ludzka ceruloplazmina zbudowana jest z 1046 aminokwasów. Zawiera ok. 90% miedzi obecnej w surowicy krwi. Bierze udział w homeostazie żelaza i mechanizmach obronnych w stresie oksydacyjnym.
 W
WCyklooksygenaza (ang. cyclooxygenase, COX, EC 1.14.99.1) – enzym odpowiedzialny za powstawanie związków chemicznych będących miejscowymi informatorami komórkowymi. Jako substratu używa on kwasu arachidonowego. Kwas arachidonowy uzyskuje dzięki enzymowi fosfolipazie A2, która odłącza arachidonian (sól kwasu arachidonowego) wbudowany w błonę komórkową, zwykle w pozycji 2 fosfolipidu błonowego.
 W
WOksydoreduktaza Q – cytochrom c, inaczej cytochrom bc1, kompleks III, kompleks oksydoreduktazy ubichinon-cytochrom c – białko błonowe łańcucha oddechowego, zlokalizowane w wewnętrznej błonie mitochondrialnej, o masie 250 kDa i zbudowane z 10 podjednostek. Zawiera grupy prostetyczne takie, jak hem bH, hem bL, hem c1 oraz Fe-S.
 W
WCytochrom P450 – cytochrom z grupy enzymów wykazujących aktywność monooksygenazy. Występują powszechnie w niemal wszystkich tkankach, największą aktywność wykazując jednak w wątrobie i rdzeniu nadnercza. Nie stwierdzono ich obecności w dojrzałych erytrocytach i mięśniach szkieletowych. W genomie człowieka znane jest około 150 różnych genów kodujących różne cytochromy P450. Spotykane wśród przedstawicieli wszystkich domen biologicznych: bakterii, archeonów, zwierząt, roślin, grzybów i pozostałych jądrowców, a nawet wśród wirusów.
 W
WDysmutaza ponadtlenkowa – enzym z grupy oksydoreduktaz katalizujący dysmutację anionorodnika ponadtlenkowego.
 W
WFerredoksyna, Fd – białko stromy chloroplastów o masie 12 kDa, zawierające grupę prostetyczną 2Fe-2S. Może występować w formie zredukowanej Fdred lub utlenionej Fdutl. Kodowane w jądrze komórkowym w formie prebiałka znakowanego N-końcowym peptydem tranzytowym, który jest odcinany przez stromalną peptydazę procesową w stromie. Tu również jest przyłączane centrum 2Fe-2S.
 W
WDehydrogenaza 11β-hydroksysteroidowa typu 1 – enzym mikrosomalny, NADPH-zależna oksydoreduktaza o wysokiej ekspresji w tkankach kluczowych metabolicznie. Katalizuje przemianę kortyzonu w kortyzol oraz w mniejszym stopniu reakcję odwrotną. Razem z dehydrogenazą 11β-hydroksysteroidową typu 2 tworzy układ regulujący poziom kortyzolu w organizmie.
 W
WKatalaza – enzym z grupy oksydoreduktaz katalizujący proces rozkładu nadtlenku wodoru do wody i tlenu. Otrzymana po raz pierwszy w postaci krystalicznej w 1937 roku przez J.B. Sumnera. Znaczne jej ilości występują w komórkach zwierzęcych np. w wątrobie, nerce, leukocytach i erytrocytach, w bakteriach tlenowych oraz w peroksysomach komórek roślinnych fotosyntezujących. Jest dobrym enzymem markerowym dla peroksysomów.
 W
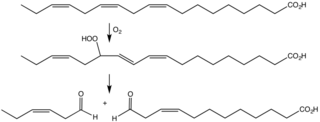
WLipooksygenaza – enzym z klasy oksygenaz katalizujący przyłączenie tlenu do jednego z wiązań podwójnych wielonienasyconych kwasów tłuszczowych, np. kwasu arachidonowego, linolowego lub oleinowego, powodując powstawanie reaktywnych wodoronadtlenków lub epitlenków. Np. ludzka 5-lipooksygenaza arachidonianu wytwarza leukotrien A4.
 W
WMonoaminooksydaza - enzym występujący w wielu tkankach ustroju zlokalizowany w cytozolu. Obecnie wyróżnia się dwa izoenzymy:MAO-A - zlokalizowany w tkance nerwowej gdzie odpowiada za deaminację serotoniny, adrenaliny i noradrenaliny oraz dopaminy i tyraminy MAO-B - znajduje się w tkankach nienerwowych. Największe powinowactwo wykazuje do fenyloetyloaminy i benzyloaminy oraz dopaminy i serotoniny.
 W
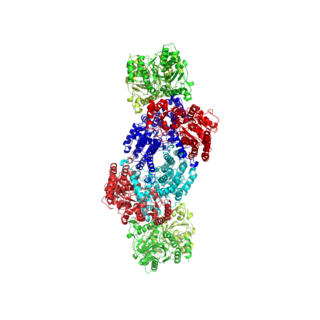
WNitrogenaza – enzym bakteryjny związany z asymilacją azotu. Jest to białko złożone zawierające centrum żelazowo-siarkowe i molibden, rzadziej wanad. Jest zbudowana z dwóch typów jednostek białkowych. Jednostka większa, tzw. białko FeMo, składa się z 4 łańcuchów polipeptydowych w układzie α2β2 i zawiera kofaktor FeMo. Po jej przeciwnych stronach przyłączone są 2 mniejsze białka żelazowe.
 W
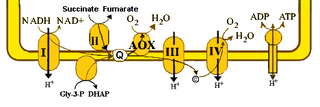
WOksydaza alternatywna (AOX z ang. alternative oxidase) – enzym obecny w wewnętrznej błonie mitochondriów roślin, glonów, grzybów i niektórych protistów. Geny kodujące AOX zostały zidentyfikowane również u przedstawicieli proteobakterii oraz zwierząt bezkręgowych należących do strunowców, półstrunowców, szkarłupni, nicieni, mięczaków, pierścienic, parzydełkowców czy gąbek. Enzym ten stwarza alternatywną możliwość przenoszenia elektronów z ubichinonu na tlen. Podczas klasycznego łańcucha oddechowego elektrony pobierane z NADH przekazywane są na ubichinon, a następnie poprzez kompleks cytochromowy bc1 i cytochrom c na oksydazę cytochromową. Oksydaza alternatywna przenosi elektrony na tlen z pominięciem kompleksu III i kompleksu IV łańcucha oddechowego. W efekcie jej działania NADH lub FADH2 zostają utlenione z wytworzeniem H2O jednak gradient elektrochemiczny nie powstaje a tym samym energia zgromadzona utlenianych NADH i FADH2 nie jest zamieniana na ATP lecz uwalniana w postaci ciepła. Szczególna cechą oksydazy alternatywnej jest jej niewrażliwość na inhibitory oksydazy cytochromowej np. cyjanek, siarkowodór, azydek, tlenek węgla oraz tlenek azotu. W tkankach zwierzęcych podanie 1 mmol l-1 KCN powoduje całkowite zatrzymanie oddychania komórkowego, w tkankach roślinnych oddychanie komórkowe zmniejsza się do poziomu 10-20% oddychania przed podaniem inhibitora. Zachodzące z udziałem oksydazy alternatywnej oddychanie komórkowe określa się jako alternatywną drogę oddechową lub oddychanie niewrażliwe na cyjanek.
 W
WOksydaza cytochromu c (też oksydaza cytochromowa, kompleks IV łańcucha oddechowego) – to duży transbłonowy kompleks białkowy błony wewnętrznej mitochondrium oraz bakterii. Jest to ostatnie białko łańcucha oddechowego (IV). Odbiera elektrony (utlenia) z cytochromów c i przenosi je na cząsteczkę tlenu, redukując go, wskutek czego po przyłączeniu jonów H+ powstają dwie cząsteczki wody. Podczas tego procesu, przenosi także przez błonę cztery jony H+, wspomagając powstawanie potencjału chemiosmotycznego.
 W
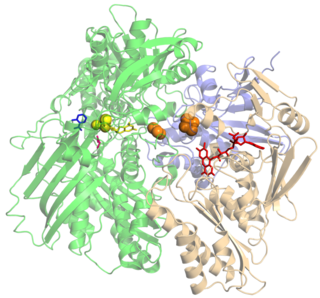
WOksydaza glukozowa – enzym z klasy oksydoreduktaz, katalizujący reakcję utleniania β-D-glukopiranozy do kwasu glukonowego. Ubocznym produktem reakcji jest nadtlenek wodoru. Dostępna handlowo zazwyczaj jako preparat otrzymywany z grzybów Aspergillus niger.
 W
WOksydaza ksantynowa – enzym z klasy oksydoreduktaz katalizujący przekształcenie hipoksantyny w ksantynę oraz ksantyny w kwas moczowy. Enzym ten odgrywa kluczową rolę w metabolizmie puryn.
 W
WReduktaza HMG-CoA, reduktaza 3-hydroksy-3-metyloglutarylokoenzymu A, EC 1.1.1.88) – enzym wątrobowy znajdujący się w cytoplazmie hepatocytów, regulujący ilość syntetyzowanego cholesterolu, a więc także wpływający na jego poziom w osoczu.
 W
WDehydrogenaza 11β-hydroksysteroidowa typu 1 – enzym mikrosomalny, NADPH-zależna oksydoreduktaza o wysokiej ekspresji w tkankach kluczowych metabolicznie. Katalizuje przemianę kortyzonu w kortyzol oraz w mniejszym stopniu reakcję odwrotną. Razem z dehydrogenazą 11β-hydroksysteroidową typu 2 tworzy układ regulujący poziom kortyzolu w organizmie.
 W
WReduktaza rybonukleotydowa (RNR) – enzym z grupy reduktaz, uczestniczący w syntezie deoksyrybonukleotydów.
 W
WSyntaza tlenku azotu (NOS, EC 1.14.13.39) – enzym przeprowadzający reakcję syntezy tlenku azotu(II) z reszty azotowej aminokwasu L-argininy w obecności NADPH i tlenu cząsteczkowego. NOS jest jedynym znanym białkiem enzymatycznym wiążącym się z FAD, FMN, hemem, tetrahydrobiopteryną (BH4) i kalmoduliną.
 W
WTioredoksyna – to niewielkie białko o masie około 12 kDa obecne w stromie chloroplastów komórek roślinnych, komórkach prokariontów oraz zwierząt. Białko zawiera sąsiadujące ze sobą reszty cysteiny, które mogą znajdować się w formie utlenionej tworząc mostek dwusiarczkowy (-S-S-) lub w formie zredukowanej, ugrupowanie tiolowe (-SH). Może ona służyć jako reduktor dla enzymów, na przykład reduktazy rybonukleotydowej przy reakcjach tworzenia difosforanów 2'-deoksyrybonukleotydów (dNDP) z difosforanów rybonukleotydów (NDP). Jedynie zredukowane formy enzymów wykazują aktywność. Aktywacja u roślin, następuje na świetle, na skutek przeniesienia elektronów z ferredoksyny na tioredoksynę w reakcji katalizowanej przez reduktazę ferredoksyna-tioredoksyna co prowadzi do zerwania mostku dwusiarczkowego, i następnie na enzymy katalizujące reakcje asymilacji CO2.